Ansichten: 0 Autor: Site Editor Veröffentlichung Zeit: 2025-01-02 Herkunft: Website









Aluminium-Luft-Batterie Salzwasserleuchten erzeugen Elektrizität durch die elektrochemische Reaktion zwischen Aluminium und Sauerstoff im Salzwasser (Elektrolyt). Wenn die Aluminiumanode die Luftkathode kontaktiert, unterliegt er einer Oxidation, freisetzt Elektronen und bildende Aluminiumionen. Die damit verbundenen chemischen Reaktionen sind wie folgt:
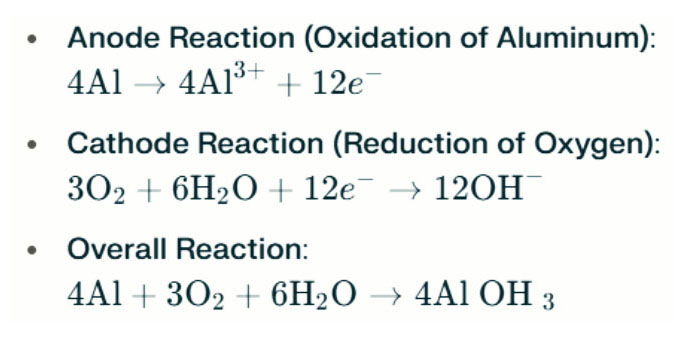
In dieser Reaktion reagiert Aluminium (AL) mit Sauerstoff (O₂) und Wasser (H₂O) auf Aluminiumhydroxid (Al (OH) ₃), das als flockiger Feststoff ausfällt. Im Laufe der Zeit können diese festen Partikel zu größeren kristallinen Strukturen aggregieren. Unter geeigneten Bedingungen kann Aluminiumhydroxid weiter dehydrieren, um Aluminiumoxid (al₂o₃) zu werden, was zu einem harten Feststoff führt, ähnlich Beton. Diese Eigenschaft ermöglicht es dem resultierenden Feststoff, signifikanten Druck und externen Kräften zu widerstehen.
Wenn Salzwasser durch einen alkalischen Elektrolyten (wie Natriumhydroxid, NaOH oder Kaliumhydroxid, KOH) ersetzt wird, unterscheiden sich die Betriebsprinzipien und Reaktionsprozesse. In alkalischen Umgebungen bleibt die Reaktion zwischen Aluminium und Sauerstoff die primäre elektrochemische Reaktion. Aufgrund der alkalischen Umgebung, die die Passivierungsschicht auf Aluminium verringert, wird die elektrochemische Aktivität jedoch verbessert. Die Reaktionen in einem alkalischen Elektrolyten können wie folgt dargestellt werden:

In diesem Fall reagiert Aluminium mit Hydroxidionen (OH⁻) und Sauerstoff zur Herstellung von Aluminiumhydroxidionen.
In starken alkalischen Umgebungen kann Aluminium eine Wasserstoffentwicklung durchlaufen und Wasserstoffgas freisetzen. Die chemischen Reaktionen sind wie folgt:
Auswirkungen der Verwendung von alkalischen Elektrolyten
Wenn Salzwasser durch einen alkalischen Elektrolyten (wie Natriumhydroxid, NaOH oder Kaliumhydroxid, KOH) ersetzt wird, unterscheiden sich die Betriebsprinzipien und Reaktionsprozesse. In alkalischen Umgebungen bleibt die Reaktion zwischen Aluminium und Sauerstoff die primäre elektrochemische Reaktion. Aufgrund der alkalischen Umgebung, die die Passivierungsschicht auf Aluminium verringert, wird die elektrochemische Aktivität jedoch verbessert. Die Reaktionen in einem alkalischen Elektrolyten können wie folgt dargestellt werden:
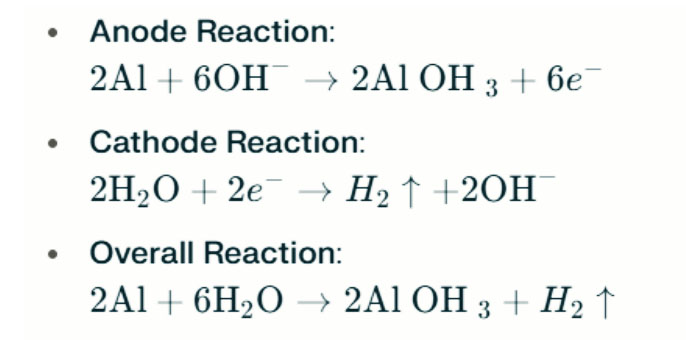
Diese Reaktionen veranschaulichen den Wasserstoffentwicklungsprozess in starken alkalischen Umgebungen, was zu einer verminderten Batterieleistung führen kann.
In alkalischen Umgebungen kann die Konzentration von Aluminiumhydroxidionen hoch genug werden, um feste Partikel auszurüsten und zu bilden. Im Laufe der Zeit können diese Partikel zu größeren Kristallen aggregieren. Zu den Ursachen der Verfestigung gehören:
Zusammenfassung
Während das Ersetzen von Salzwasser durch einen alkalischen Elektrolyt zu ähnlichen Betriebsprinzipien und Reaktionsprozessen führt, kann der Einfluss der alkalischen Umgebung auf die Aktivität von Aluminiummetall- und Wasserstoffentwicklungskorrosion zu Unterschieden in den endgültigen festen Produkten und deren Eigenschaften führen. Diese Veränderungen können die Reaktionseffizienz verbessern, aber auch Probleme mit Selbstkorrosion einführen.
