Megtekintések: 0 Szerző: A webhelyszerkesztő közzététele idő: 2025-01-02 Origin: Telek









Alumínium-levegő akkumulátor A sósvízi lámpák villamos energiát generálnak az alumínium és az oxigén közötti elektrokémiai reakció révén (az elektrolit). Amikor az alumínium anód érintkezik a levegő katódjával, oxidáción megy keresztül, elektronokat szabadít fel és alumíniumionokat képez. A kapcsolódó kémiai reakciók a következők:
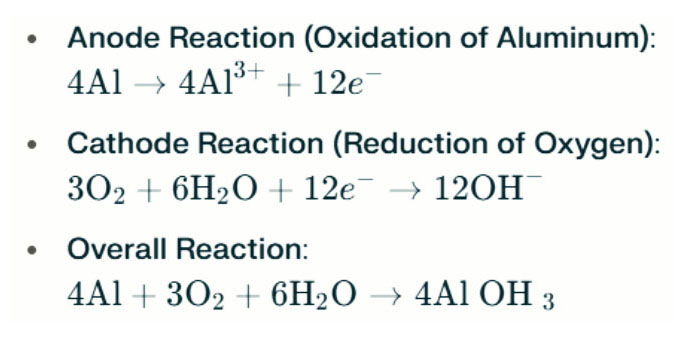
Ebben a reakcióban az alumínium (AL) reagál az oxigénnel (O₂) és a vízzel (H₂O), hogy alumínium -hidroxidot (AL (OH) ₃) termeljen, amely flokkulens szilárd anyagként csapható be. Az idő múlásával ezek a szilárd részecskék aggregálódhatnak, hogy nagyobb kristályos szerkezeteket képezzenek. Megfelelő körülmények között az alumínium -hidroxid tovább kiszáradhat, hogy alumínium -oxidgá váljon (Al₂O₃), ami a betonhoz hasonló kemény szilárd anyagot eredményez. Ez a tulajdonság lehetővé teszi a kapott szilárd anyag számára, hogy ellenálljon a szignifikáns nyomásnak és a külső erőknek.
Ha a sós vizet lúgos elektrolitra (például nátrium -hidroxid, NaOH vagy kálium -hidroxid, KOH) cserélik, akkor a működési alapelvek és a reakció folyamata eltérő. Lúgos környezetben az alumínium és az oxigén közötti reakció továbbra is az elsődleges elektrokémiai reakció. Mivel azonban az lúgos környezet csökkenti az alumínium passzivációs réteget, az elektrokémiai aktivitása fokozódik. A lúgos elektrolit reakciói a következőképpen ábrázolhatók:

Ebben az esetben az alumínium reagál a hidroxid -ionokkal (OH⁻) és az oxigénnel, hogy alumínium -hidroxid -ionokat termeljen.
Erős lúgos környezetben az alumínium hidrogén evolúciós korrózión eshet át, felszabadítva a hidrogéngázt. A kémiai reakciók a következők:
Lúgos elektrolitok használatának hatása
Ha a sós vizet lúgos elektrolitra (például nátrium -hidroxid, NaOH vagy kálium -hidroxid, KOH) cserélik, akkor a működési alapelvek és a reakció folyamata eltérő. Lúgos környezetben az alumínium és az oxigén közötti reakció továbbra is az elsődleges elektrokémiai reakció. Mivel azonban az lúgos környezet csökkenti az alumínium passzivációs réteget, az elektrokémiai aktivitása fokozódik. A lúgos elektrolit reakciói a következőképpen ábrázolhatók:
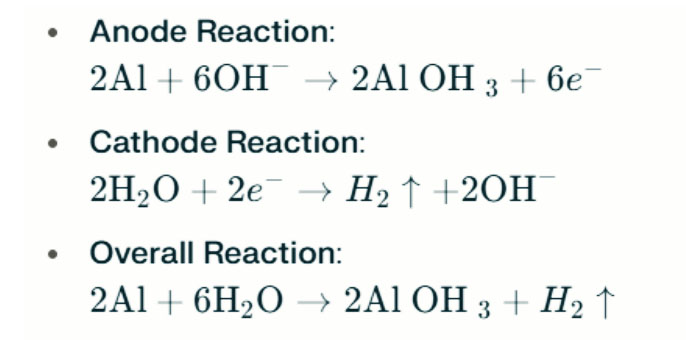
Ezek a reakciók szemléltetik a hidrogén evolúciós folyamatot erős lúgos környezetben, ami csökkent az akkumulátor teljesítményéhez.
Lúgos környezetben az alumínium -hidroxid -ionok koncentrációja elég magasra válhat ahhoz, hogy kicsapódjanak és szilárd részecskéket képezzenek. Az idő múlásával ezek a részecskék nagyobb kristályokká válhatnak. A megszilárdulás okai a következők:
Összefoglalás
Így, miközben a sós vizet lúgos elektrolitokkal történő cseréje hasonló működési alapelveket és reakciófolyamatokat eredményez, az lúgos környezet hatása az alumínium fém és a hidrogén evolúció korróziójának aktivitására a végső szilárd termékek és azok jellemzői különbségeihez vezethet. Ezek a változások javíthatják a reakció hatékonyságát, de önkorróziós problémákat is bevezethetnek.
