Pandangan: 0 Pengarang: Editor Tapak Menerbitkan Masa: 2025-01-02 Asal: Tapak









Bateri Aluminium-Air Lampu air masin menjana elektrik melalui tindak balas elektrokimia antara aluminium dan oksigen dalam air masin (elektrolit). Apabila anod aluminium menyentuh katod udara, ia mengalami pengoksidaan, melepaskan elektron dan membentuk ion aluminium. Reaksi kimia yang terlibat adalah seperti berikut:
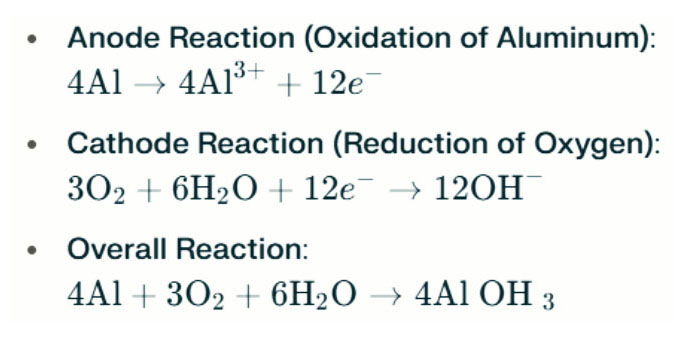
Dalam tindak balas ini, aluminium (Al) bertindak balas dengan oksigen (O₂) dan air (H₂O) untuk menghasilkan aluminium hidroksida (Al (OH) ₃), yang mendahului sebagai pepejal flocculent. Dari masa ke masa, zarah pepejal ini boleh agregat untuk membentuk struktur kristal yang lebih besar. Di bawah keadaan yang sesuai, aluminium hidroksida dapat dehidrasi lagi menjadi aluminium oksida (Al₂o₃), menghasilkan pepejal keras yang serupa dengan konkrit. Ciri ini membolehkan pepejal yang dihasilkan untuk menahan tekanan dan daya luaran yang ketara.
Jika air masin digantikan dengan elektrolit alkali (seperti natrium hidroksida, NaOH, atau kalium hidroksida, KOH), prinsip operasi dan proses tindak balas akan berbeza. Dalam persekitaran alkali, tindak balas antara aluminium dan oksigen kekal sebagai tindak balas elektrokimia utama. Walau bagaimanapun, disebabkan oleh persekitaran alkali yang mengurangkan lapisan passivation pada aluminium, aktiviti elektrokimia dipertingkatkan. Reaksi dalam elektrolit alkali boleh diwakili seperti berikut:

Dalam kes ini, aluminium bertindak balas dengan ion hidroksida (OH⁻) dan oksigen untuk menghasilkan ion hidroksida aluminium.
Dalam persekitaran alkali yang kuat, aluminium boleh menjalani kakisan evolusi hidrogen, melepaskan gas hidrogen. Reaksi kimia adalah seperti berikut:
Kesan menggunakan elektrolit alkali
Jika air masin digantikan dengan elektrolit alkali (seperti natrium hidroksida, NaOH, atau kalium hidroksida, KOH), prinsip operasi dan proses tindak balas akan berbeza. Dalam persekitaran alkali, tindak balas antara aluminium dan oksigen kekal sebagai tindak balas elektrokimia utama. Walau bagaimanapun, disebabkan oleh persekitaran alkali yang mengurangkan lapisan passivation pada aluminium, aktiviti elektrokimia dipertingkatkan. Reaksi dalam elektrolit alkali boleh diwakili seperti berikut:
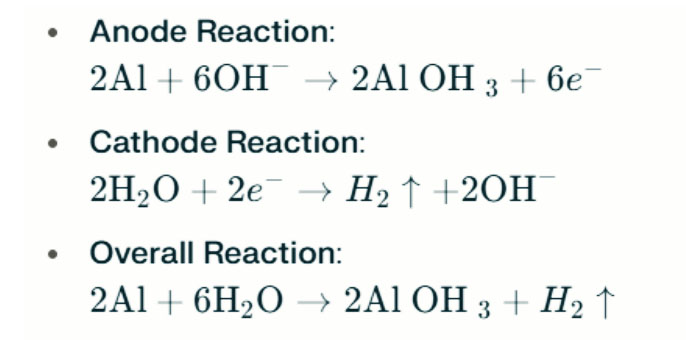
Reaksi ini menggambarkan proses evolusi hidrogen dalam persekitaran alkali yang kuat, yang boleh menyebabkan penurunan prestasi bateri.
Dalam persekitaran alkali, kepekatan ion hidroksida aluminium boleh menjadi cukup tinggi bagi mereka untuk mendakan dan membentuk zarah pepejal. Dari masa ke masa, zarah -zarah ini boleh agregat menjadi kristal yang lebih besar. Punca pemejalan termasuk:
Ringkasan
Oleh itu, semasa menggantikan air masin dengan elektrolit alkali menghasilkan prinsip operasi dan proses reaksi yang sama, pengaruh persekitaran alkali terhadap aktiviti logam aluminium dan kakisan evolusi hidrogen dapat menyebabkan perbezaan produk pepejal akhir dan ciri -ciri mereka. Perubahan ini dapat meningkatkan kecekapan tindak balas tetapi juga memperkenalkan isu karat diri.
