Vues: 0 Auteur: Éditeur de site Temps de publication: 2025-01-02 Origine: Site









Batterie en aluminium Les lampes d'eau salée génèrent de l'électricité par la réaction électrochimique entre l'aluminium et l'oxygène dans l'eau salée (l'électrolyte). Lorsque l'anode en aluminium entre en contact avec la cathode air, il subit une oxydation, libérant des électrons et formant des ions en aluminium. Les réactions chimiques impliquées sont les suivantes:
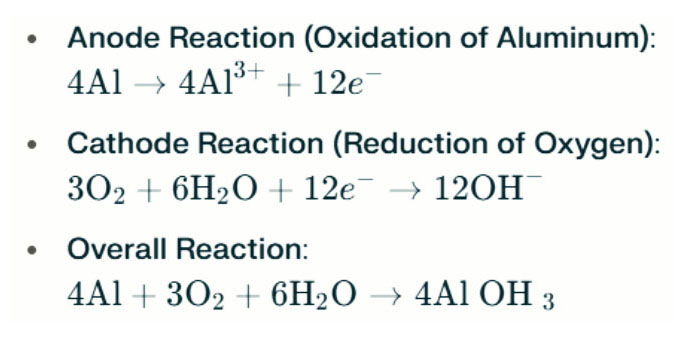
Dans cette réaction, l'aluminium (AL) réagit avec l'oxygène (O₂) et l'eau (H₂O) pour produire de l'hydroxyde d'aluminium (AL (OH) ₃), qui précipite comme un solide flocule. Au fil du temps, ces particules solides peuvent s'agréger pour former des structures cristallines plus grandes. Dans des conditions appropriées, l'hydroxyde d'aluminium peut déshydrater davantage pour devenir de l'oxyde d'aluminium (al₂o₃), résultant en un solide dur similaire au béton. Cette caractéristique permet au solide résultant de résister à une pression importante et à des forces externes.
Si l'eau salée est remplacée par un électrolyte alcalin (comme l'hydroxyde de sodium, le NaOH ou l'hydroxyde de potassium, KOH), les principes de fonctionnement et les processus de réaction différeront. Dans les environnements alcalins, la réaction entre l'aluminium et l'oxygène reste la principale réaction électrochimique. Cependant, en raison de l'environnement alcalin réduisant la couche de passivation sur l'aluminium, son activité électrochimique est améliorée. Les réactions dans un électrolyte alcalin peuvent être représentées comme suit:

Dans ce cas, l'aluminium réagit avec les ions d'hydroxyde (OH⁻) et l'oxygène pour produire des ions d'hydroxyde d'aluminium.
Dans des environnements alcalins forts, l'aluminium peut subir une corrosion d'évolution de l'hydrogène, libérant de l'hydrogène gazeux. Les réactions chimiques sont les suivantes:
Impact de l'utilisation d'électrolytes alcalins
Si l'eau salée est remplacée par un électrolyte alcalin (comme l'hydroxyde de sodium, le NaOH ou l'hydroxyde de potassium, KOH), les principes de fonctionnement et les processus de réaction différeront. Dans les environnements alcalins, la réaction entre l'aluminium et l'oxygène reste la principale réaction électrochimique. Cependant, en raison de l'environnement alcalin réduisant la couche de passivation sur l'aluminium, son activité électrochimique est améliorée. Les réactions dans un électrolyte alcalin peuvent être représentées comme suit:
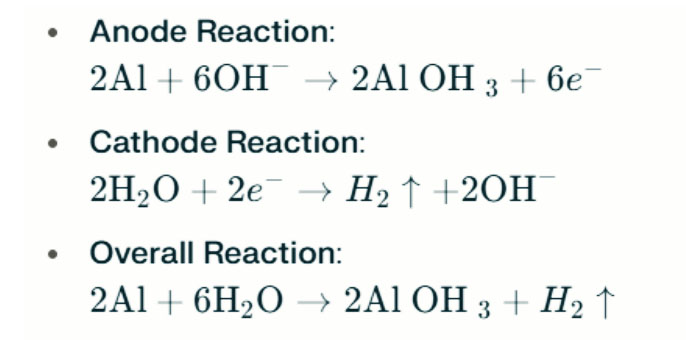
Ces réactions illustrent le processus d'évolution de l'hydrogène dans de forts environnements alcalins, ce qui peut entraîner une diminution des performances de la batterie.
Dans les environnements alcalins, la concentration des ions d'hydroxyde d'aluminium peut devenir suffisamment élevée pour qu'elles précipitent et forment des particules solides. Au fil du temps, ces particules peuvent s'agréger en cristaux plus grands. Les causes de la solidification comprennent:
Résumé
Ainsi, tout en remplaçant l'eau salée par un électrolyte alcalin entraîne des principes de fonctionnement et des processus de réaction similaires, l'influence de l'environnement alcalin sur l'activité de la corrosion d'évolution des métaux en aluminium et de l'hydrogène peut entraîner des différences dans les produits solides finaux et leurs caractéristiques. Ces changements peuvent améliorer l'efficacité de la réaction, mais également introduire des problèmes d'autorosion.
