Tuairimí: 0 Údar: Eagarthóir Láithreáin Foilsiú Am: 2025-01-02 Tionscnamh: Suigh









Ceallraí alúmanaim Cruthaíonn lampaí sáile leictreachas tríd an imoibriú leictriceimiceach idir alúmanam agus ocsaigin i sáile (an leictrilít). Nuair a théann an anóid alúmanaim i dteagmháil leis an gcatóid aeir, déanann sé ocsaídiú, ag scaoileadh leictreoin agus ag cruthú ian alúmanaim. Seo a leanas na frithghníomhartha ceimiceacha atá i gceist:
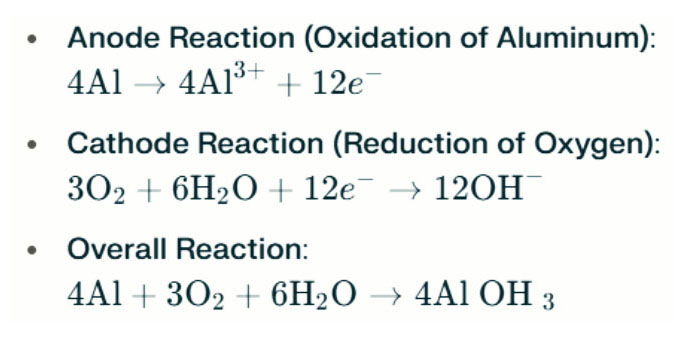
San imoibriú seo, imoibríonn alúmanam (AL) le hocsaigin (O₂) agus le huisce (H₂O) chun hiodrocsaíd alúmanaim (Al (OH) ₃) a tháirgeadh, a chuireann as a chéile mar sholadach flocanach. Le himeacht ama, is féidir leis na cáithníní soladacha seo comhiomlánú a dhéanamh chun struchtúir chriostalach níos mó a dhéanamh. Faoi choinníollacha oiriúnacha, is féidir le hiodrocsaíd alúmanaim díhiodráitiú a thuilleadh le bheith ina ocsaíd alúmanaim (al₂o₃), agus mar thoradh air sin tá solad crua cosúil le coincréit. Ligeann an tréith seo don solad a leanann as brú suntasach agus fórsaí seachtracha a sheasamh.
Má chuirtear leictrilít alcaileach in ionad sáile (mar shampla hiodrocsaíd sóidiam, NaOH, nó hiodrocsaíd photaisiam, KOH), beidh difríocht idir na prionsabail oibriúcháin agus na próisis imoibriúcháin. I dtimpeallachtaí alcaileacha, is é an t -imoibriú idir alúmanam agus ocsaigin an príomh -imoibriú leictriceimiceach. Mar sin féin, mar gheall ar an timpeallacht alcaileach a laghdaíonn an ciseal éighníomhach ar alúmanam, cuirtear feabhas ar a ghníomhaíocht leictriceimiceach. Is féidir na himoibrithe i leictrilít alcaileach a léiriú mar seo a leanas:

Sa chás seo, imoibríonn alúmanam le hiain hiodrocsaíde (OH⁻) agus ocsaigin chun ian hiodrocsaíde alúmanaim a tháirgeadh.
I dtimpeallachtaí alcaileacha láidre, is féidir le alúmanam creimeadh éabhlóid hidrigine a dhéanamh, ag scaoileadh gáis hidrigine. Seo a leanas na frithghníomhartha ceimiceacha:
Tionchar leictrilítí alcaileach a úsáid
Má chuirtear leictrilít alcaileach in ionad sáile (mar shampla hiodrocsaíd sóidiam, NaOH, nó hiodrocsaíd photaisiam, KOH), beidh difríocht idir na prionsabail oibriúcháin agus na próisis imoibriúcháin. I dtimpeallachtaí alcaileacha, is é an t -imoibriú idir alúmanam agus ocsaigin an príomh -imoibriú leictriceimiceach. Mar sin féin, mar gheall ar an timpeallacht alcaileach a laghdaíonn an ciseal éighníomhach ar alúmanam, cuirtear feabhas ar a ghníomhaíocht leictriceimiceach. Is féidir na himoibrithe i leictrilít alcaileach a léiriú mar seo a leanas:
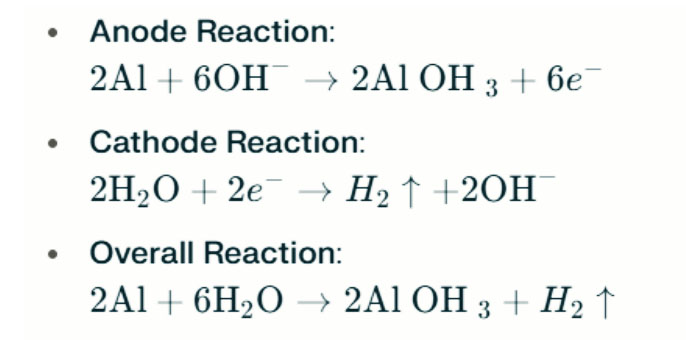
Léiríonn na frithghníomhartha seo an próiseas éabhlóid hidrigine i dtimpeallachtaí alcaileacha láidre, a bhféadfadh feidhmíocht ceallraí laghdaithe a bheith mar thoradh orthu.
I dtimpeallachtaí alcaileacha, is féidir le tiúchan na n -ian hiodrocsaíde alúmanaim a bheith ard go leor chun iad a mhaolú agus a fhoirmiú. Le himeacht ama, is féidir leis na cáithníní seo comhiomlán a dhéanamh i gcriostail níos mó. I measc na gcúiseanna a bhaineann le soladú tá:
Achoimre
Dá bhrí sin, cé go mbíonn prionsabail oibriúcháin agus próisis imoibriúcháin chomhchosúla mar thoradh ar sháile sáile a chur in ionad sáile, is féidir le tionchar na timpeallachta alcaileach ar ghníomhaíocht miotail alúmanaim agus creimeadh éabhlóid hidrigine a bheith mar thoradh ar dhifríochtaí sna táirgí soladacha deiridh agus a saintréithe. D'fhéadfadh na hathruithe seo feabhas a chur ar éifeachtúlacht imoibriúcháin ach freisin saincheisteanna féin-chreimthe a thabhairt isteach.
