Please Choose Your Language
Weergaven: 0 Auteur: Site Editor Publiceren Tijd: 2025-01-02 Oorsprong: Site









Aluminium-luchtbatterij Zoutwaterlampen genereren elektriciteit door de elektrochemische reactie tussen aluminium en zuurstof in zoutwater (de elektrolyt). Wanneer de aluminiumanode contact opneemt met de luchtkathode, ondergaat deze oxidatie, waardoor elektronen worden vrijgeeft en aluminiumionen vormt. De betrokken chemische reacties zijn als volgt:
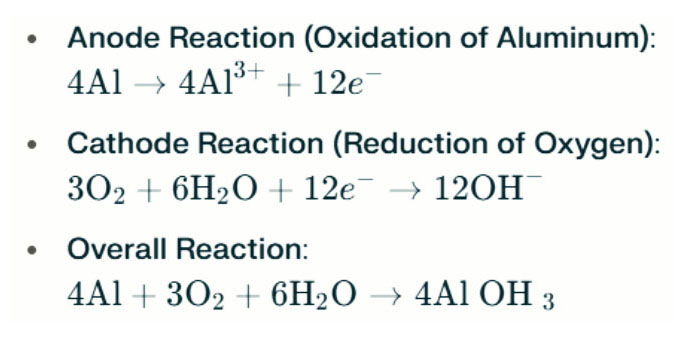
In deze reactie reageert aluminium (Al) met zuurstof (O₂) en water (H₂o) om aluminiumhydroxide (AL (OH) ₃) te produceren, die neerslaat als een vlokkelijke vaste stof. Na verloop van tijd kunnen deze vaste deeltjes aggregeren om grotere kristallijne structuren te vormen. Onder geschikte omstandigheden kan aluminiumhydroxide verder dehydrateren om aluminiumoxide (al₂o₃) te worden, wat resulteert in een harde vaste stof vergelijkbaar met beton. Met dit kenmerk kan de resulterende vaste stof significante druk en externe krachten weerstaan.
Als zoutwater wordt vervangen door een alkalische elektrolyt (zoals natriumhydroxide, NaOH of kaliumhydroxide, KOH), zullen de operationele principes en reactieprocessen verschillen. In alkalische omgevingen blijft de reactie tussen aluminium en zuurstof de primaire elektrochemische reactie. Vanwege de alkalische omgeving die de passiveringslaag op aluminium vermindert, wordt echter de elektrochemische activiteit verbeterd. De reacties in een alkalische elektrolyt kunnen als volgt worden weergegeven:

In dit geval reageert aluminium met hydroxide -ionen (OH⁻) en zuurstof om aluminiumhydroxide -ionen te produceren.
In sterke alkalische omgevingen kan aluminium de corrosie van waterstofevolutie ondergaan, waardoor waterstofgas wordt vrijgelaten. De chemische reacties zijn als volgt:
Impact van het gebruik van alkalische elektrolyten
Als zoutwater wordt vervangen door een alkalische elektrolyt (zoals natriumhydroxide, NaOH of kaliumhydroxide, KOH), zullen de operationele principes en reactieprocessen verschillen. In alkalische omgevingen blijft de reactie tussen aluminium en zuurstof de primaire elektrochemische reactie. Vanwege de alkalische omgeving die de passiveringslaag op aluminium vermindert, wordt echter de elektrochemische activiteit verbeterd. De reacties in een alkalische elektrolyt kunnen als volgt worden weergegeven:
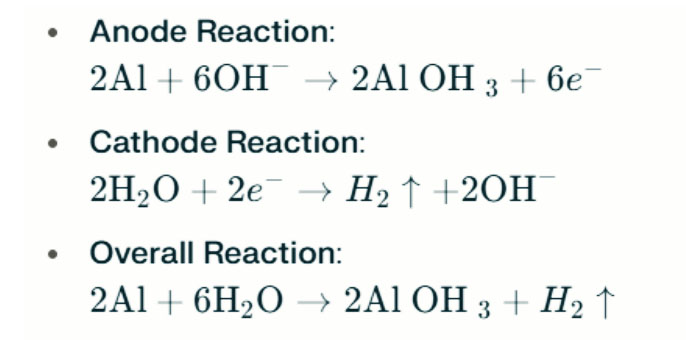
Deze reacties illustreren het waterstofevolutieproces in sterke alkalische omgevingen, wat kan leiden tot verminderde batterijprestaties.
In alkalische omgevingen kan de concentratie van aluminiumhydroxide -ionen hoog genoeg worden om te neerslachten en vaste deeltjes te vormen. Na verloop van tijd kunnen deze deeltjes aggregeren in grotere kristallen. De oorzaken van stolling zijn onder meer:
Samenvatting
Hoewel het vervangen van zoutwater door een alkalische elektrolyt te vervangen, kan de invloed van de alkalische omgeving op de activiteit van aluminiummetaal en waterstofevolutie corrosie dus leiden tot verschillen in de uiteindelijke vaste producten en hun kenmerken. Deze veranderingen kunnen de reactieefficiëntie verbeteren, maar ook zelfcorrosieproblemen introduceren.
