Mga Views: 0 May-akda: Site Editor Nag-publish ng Oras: 2025-01-02 Pinagmulan: Site









Aluminyo-air baterya Ang mga lampara ng tubig -alat ay bumubuo ng koryente sa pamamagitan ng electrochemical reaksyon sa pagitan ng aluminyo at oxygen sa tubig -alat (ang electrolyte). Kapag ang aluminyo anode ay nakikipag -ugnay sa air cathode, sumasailalim ito ng oksihenasyon, naglalabas ng mga electron at bumubuo ng mga ion ng aluminyo. Ang mga reaksyon ng kemikal na kasangkot ay ang mga sumusunod:
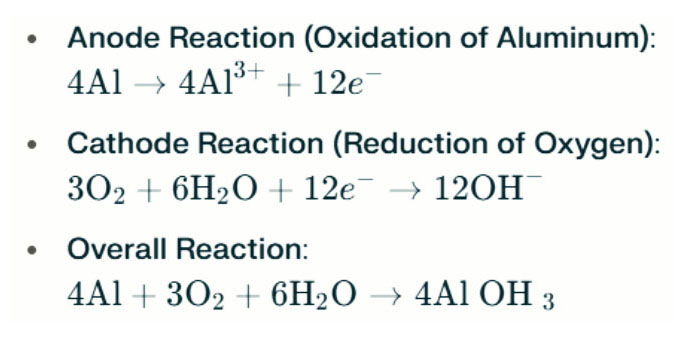
Sa reaksyon na ito, ang aluminyo (AL) ay gumanti sa oxygen (O₂) at tubig (H₂O) upang makabuo ng aluminyo hydroxide (Al (OH) ₃), na umuusbong bilang isang flocculent solid. Sa paglipas ng panahon, ang mga solidong partikulo na ito ay maaaring pinagsama -sama upang makabuo ng mas malaking mga istruktura ng mala -kristal. Sa ilalim ng angkop na mga kondisyon, ang aluminyo hydroxide ay maaaring higit na mag -aalis ng tubig upang maging aluminyo oxide (al₂o₃), na nagreresulta sa isang matigas na solid na katulad ng kongkreto. Ang katangian na ito ay nagbibigay -daan sa nagreresultang solid upang mapaglabanan ang makabuluhang presyon at panlabas na puwersa.
Kung ang tubig -alat ay pinalitan ng isang alkalina na electrolyte (tulad ng sodium hydroxide, NaOH, o potassium hydroxide, KOH), ang mga prinsipyo ng operating at mga proseso ng reaksyon ay magkakaiba. Sa mga alkalina na kapaligiran, ang reaksyon sa pagitan ng aluminyo at oxygen ay nananatiling pangunahing reaksyon ng electrochemical. Gayunpaman, dahil sa alkalina na kapaligiran na binabawasan ang layer ng passivation sa aluminyo, ang aktibidad na electrochemical nito ay pinahusay. Ang mga reaksyon sa isang alkalina na electrolyte ay maaaring kinatawan ng mga sumusunod:

Sa kasong ito, ang aluminyo ay gumanti sa mga hydroxide ion (OH⁻) at oxygen upang makabuo ng mga ion ng hydroxide ng aluminyo.
Sa malakas na mga alkalina na kapaligiran, ang aluminyo ay maaaring sumailalim sa kaagnasan ng ebolusyon ng hydrogen, na naglalabas ng gasolina ng hydrogen. Ang mga reaksyon ng kemikal ay ang mga sumusunod:
Epekto ng paggamit ng alkalina na electrolyte
Kung ang tubig -alat ay pinalitan ng isang alkalina na electrolyte (tulad ng sodium hydroxide, NaOH, o potassium hydroxide, KOH), ang mga prinsipyo ng operating at mga proseso ng reaksyon ay magkakaiba. Sa mga alkalina na kapaligiran, ang reaksyon sa pagitan ng aluminyo at oxygen ay nananatiling pangunahing reaksyon ng electrochemical. Gayunpaman, dahil sa alkalina na kapaligiran na binabawasan ang layer ng passivation sa aluminyo, ang aktibidad na electrochemical nito ay pinahusay. Ang mga reaksyon sa isang alkalina na electrolyte ay maaaring kinatawan ng mga sumusunod:
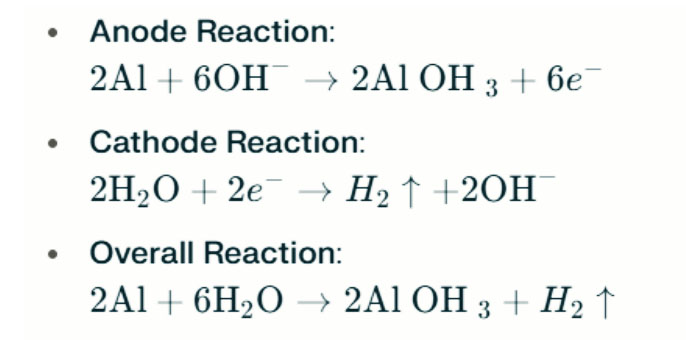
Ang mga reaksyon na ito ay naglalarawan ng proseso ng ebolusyon ng hydrogen sa malakas na mga alkalina na kapaligiran, na maaaring humantong sa nabawasan na pagganap ng baterya.
Sa mga alkalina na kapaligiran, ang konsentrasyon ng mga aluminyo hydroxide ion ay maaaring maging sapat na mataas para sa kanila upang mapukaw at mabuo ang mga solidong partikulo. Sa paglipas ng panahon, ang mga particle na ito ay maaaring magkasama sa mas malaking mga kristal. Ang mga sanhi ng solidification ay kasama ang:
Buod
Kaya, habang pinapalitan ang tubig -alat na may alkalina na electrolyte ay nagreresulta sa magkatulad na mga prinsipyo ng operating at mga proseso ng reaksyon, ang impluwensya ng kapaligiran ng alkalina sa aktibidad ng aluminyo metal at hydrogen evolution corrosion ay maaaring humantong sa mga pagkakaiba sa pangwakas na solidong produkto at kanilang mga katangian. Ang mga pagbabagong ito ay maaaring mapabuti ang kahusayan ng reaksyon ngunit ipakilala din ang mga isyu sa pagmumura sa sarili.
