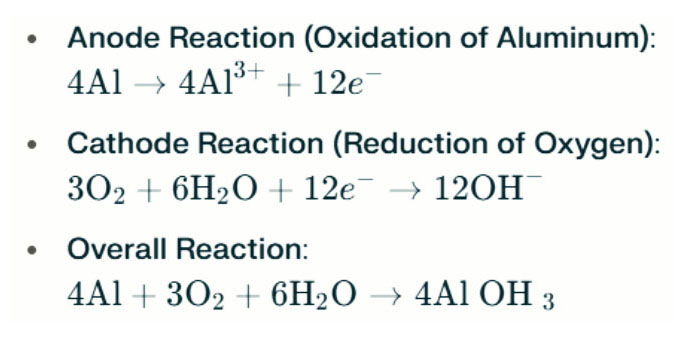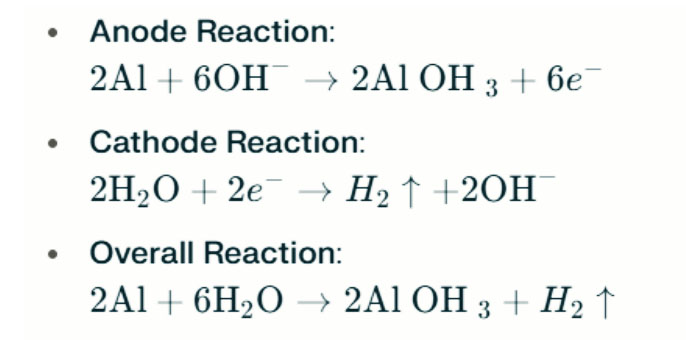Принцип дії
Алюмінієво-повітряний акумулятор лампи з морською водою виробляють електрику завдяки електрохімічній реакції між алюмінієм і киснем у солоній воді (електроліт). Коли алюмінієвий анод контактує з повітряним катодом, він піддається окисленню, вивільняючи електрони та утворюючи іони алюмінію. Задіяні хімічні реакції такі:
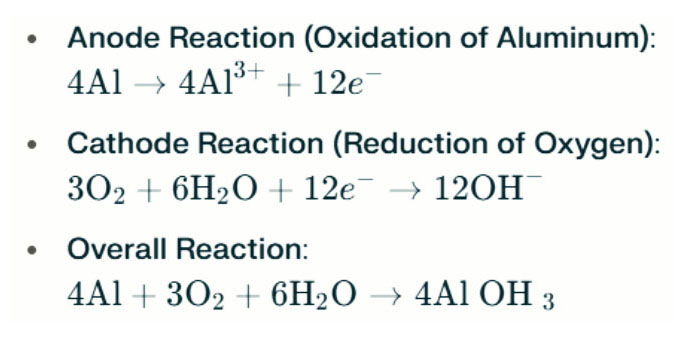
У цій реакції алюміній (Al) реагує з киснем (O₂) і водою (H₂O) з утворенням гідроксиду алюмінію (Al(OH)3), який випадає в осад у вигляді пластівчастої твердої речовини. З часом ці тверді частинки можуть агрегувати, утворюючи більші кристалічні структури. За відповідних умов гідроксид алюмінію може далі дегідратуватися, перетворюючись на оксид алюмінію (Al₂O₃), у результаті чого утворюється тверда тверда речовина, схожа на бетон. Ця характеристика дозволяє отриманій твердій речовині витримувати значний тиск і зовнішні сили.
Вплив використання лужних електролітів
Якщо солону воду замінити лужним електролітом (наприклад, гідроксидом натрію, NaOH або гідроксидом калію, KOH), принципи роботи та процеси реакції відрізнятимуться. У лужних середовищах реакція між алюмінієм і киснем залишається основною електрохімічною реакцією. Однак завдяки лужному середовищу, що зменшує шар пасивації на алюмінії, його електрохімічна активність посилюється. Реакції в лужному електроліті можна представити так:

У цьому випадку алюміній реагує з іонами гідроксиду (OH⁻) і киснем, утворюючи іони гідроксиду алюмінію.
Феномен виділення водню
У сильних лужних середовищах алюміній може піддаватися корозії з виділенням водню, вивільняючи газоподібний водень. Хімічні реакції такі:
Вплив використання лужних електролітів
Якщо солону воду замінити лужним електролітом (наприклад, гідроксидом натрію, NaOH або гідроксидом калію, KOH), принципи роботи та процеси реакції відрізнятимуться. У лужних середовищах реакція між алюмінієм і киснем залишається основною електрохімічною реакцією. Однак завдяки лужному середовищу, що зменшує шар пасивації на алюмінії, його електрохімічна активність посилюється. Реакції в лужному електроліті можна представити так:
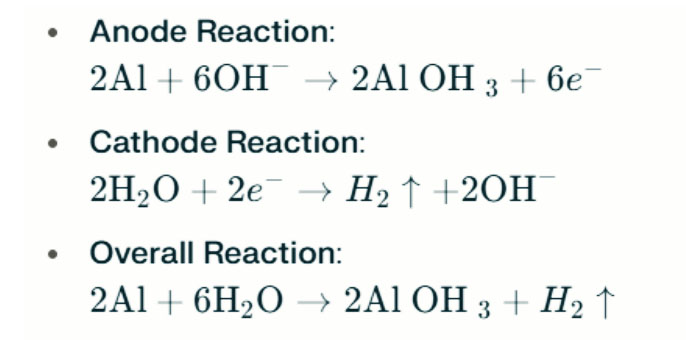
Ці реакції ілюструють процес виділення водню в сильних лужних середовищах, що може призвести до зниження продуктивності акумулятора.
Формування та зміцнення твердого тіла
У лужному середовищі концентрація іонів гідроксиду алюмінію може стати достатньо високою, щоб вони випали в осад і утворили тверді частинки. З часом ці частинки можуть агрегувати у більші кристали. Причини затвердіння включають:
1. Осадження та агрегація:
Утворений гідроксид алюмінію осідає в електроліті і поступово утворює більші частинки.
2. Конверсія зневоднення:
За певних умов гідроксид алюмінію може зневоднюватись і перетворюватися на більш твердий оксид алюмінію (Al₂O₃), що призводить до дуже твердої твердої речовини.
3. Вплив на навколишнє середовище:
Лужне середовище може призвести до більш щільних структур отриманого твердого матеріалу, підвищуючи його твердість.
Резюме
Таким чином, хоча заміна солоної води лужним електролітом призводить до схожих принципів роботи та реакційних процесів, вплив лужного середовища на активність металевого алюмінію та корозію з виділенням водню може призвести до відмінностей у кінцевих твердих продуктах та їхніх характеристиках. Ці зміни можуть підвищити ефективність реакції, але також можуть викликати проблеми самокорозії.
Рекомендації щодо використання ламп із морською водою
1. Хімічні реакції:
Коли додається солона вода, алюмінієва пластина реагує з киснем повітря, утворюючи гідроксид алюмінію. Ця сполука накопичується з часом і утворює тверді частинки, які згодом можуть об’єднатися у більші маси.
1. Споживання алюмінієвих пластин:
Якщо є велика кількість солоної води, усі алюмінієві пластини будуть витрачені; якщо солоної води менше, споживатимуться переважно нижні тарілки. Це призводить до нерівномірної товщини плит.
2. Вплив твердих частинок:
Оскільки хімічні реакції триватимуть, накопичення внутрішнього гідроксиду алюмінію та утворення твердих частинок збільшить тиск на алюмінієві пластини.
3. Перевірка плинності:
Рекомендується щодня перевіряти плинність утвореного гідроксиду алюмінію. Якщо текучість значно зменшується, замініть її прісною солоною водою; інакше затверділі частинки може бути важко очистити.
5. Обробка після використання:
Якщо не використовувати протягом трьох годин, негайно випорожніть і промийте внутрішню частину лампи з морською водою , потім висушіть її в провітрюваному місці, зберігаючи в прохолодному сухому місці.
6. Феномен пасивації:
Після багаторазового використання залишки солоної води можуть бути не повністю змиті, що призведе до пасивації на поверхні алюмінієвих пластин. Коли додається нова солона вода, спочатку увімкніть лампу, щоб розрядити її; це призведе до порушення шару пасивації на пластинах і відновлення нормальної роботи.
7. Довговічність і екологічність:
Соляні лампи мають термін служби не менше 120 годин і можуть зберігатися до 20 років, не вимагаючи додаткового обслуговування під час зберігання. Будучи новим типом екологічно чистого продукту, вони підходять для використання як аварійне освітлення, інструменти для навчання або заряджання електронних пристроїв у різних місцях, таких як будинки, готелі, сценарії пожежогасіння, риболовля, походи, екскурсії тощо. Замовлення вітаються!
English
العربية
Français
Русский
Español
Português
Deutsch
italiano
日本語
한국어
Nederlands
Tiếng Việt
ไทย
Polski
Türkçe
አማርኛ
ພາສາລາວ
ភាសាខ្មែរ
Bahasa Melayu
ဗမာစာ
தமிழ்
Filipino
Bahasa Indonesia
magyar
Română
Čeština
Монгол
қазақ
Српски
हिन्दी
فارسی
Kiswahili
Slovenčina
Slovenščina
Norsk
Svenska
українська
Ελληνικά
Suomi
Հայերեն
עברית
اردو
Afrikaans
Gaeilge
नेपाली
Aymara
Беларуская мова
guarani
Krio we dɛn kɔl Krio
Runasimi
Wikang Tagalog