Ogledi: 0 Avtor: Urejevalnik spletnega mesta Čas: 2025-01-02 Izvor: Mesto









Aluminijasta air baterija Slane svetilke proizvajajo elektriko z elektrokemično reakcijo med aluminijem in kisikom v slani vodi (elektrolit). Ko aluminijeva anoda stopi v stik z zračno katodo, je podvržena oksidaciji, sprošča elektrone in tvori aluminijeve ione. Vključene kemične reakcije so naslednje:
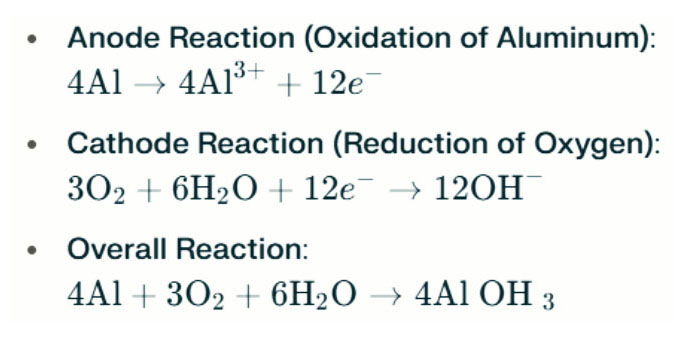
V tej reakciji aluminij (AL) reagira s kisikom (O₂) in vodo (H₂o), da nastane aluminijev hidroksid (Al (OH) ₃), ki obori kot flokulentno trdno snov. Sčasoma se lahko ti trdni delci združijo tako, da tvorijo večje kristalne strukture. V primernih pogojih lahko aluminijev hidroksid še dodatno dehidrira, da postane aluminijev oksid (AL₂O₃), kar ima za posledico trdo trdno snov, podobno betonu. Ta značilnost omogoča, da nastala trdna snov zdrži pomemben tlak in zunanje sile.
Če se slana voda nadomesti z alkalnim elektrolitom (kot so natrijev hidroksid, NaOH ali kalijev hidroksid, KOH), se bodo delovna načela in reakcijski procesi razlikovali. V alkalnem okolju reakcija med aluminijem in kisikom ostaja primarna elektrokemična reakcija. Vendar se zaradi alkalnega okolja, ki zmanjšuje pasivacijsko plast na aluminiju, poveča njegova elektrokemična aktivnost. Reakcije v alkalnem elektrolitu so lahko predstavljene na naslednji način:

V tem primeru aluminij reagira s hidroksidnimi ioni (OH⁻) in kisikom, da nastane aluminijevi hidroksidni ioni.
V močnem alkalnem okolju lahko aluminij podvrže evolucijski koroziji vodika in sprošča vodikov plin. Kemične reakcije so naslednje:
Vpliv uporabe alkalnih elektrolitov
Če se slana voda nadomesti z alkalnim elektrolitom (kot so natrijev hidroksid, NaOH ali kalijev hidroksid, KOH), se bodo delovna načela in reakcijski procesi razlikovali. V alkalnem okolju reakcija med aluminijem in kisikom ostaja primarna elektrokemična reakcija. Vendar se zaradi alkalnega okolja, ki zmanjšuje pasivacijsko plast na aluminiju, poveča njegova elektrokemična aktivnost. Reakcije v alkalnem elektrolitu so lahko predstavljene na naslednji način:
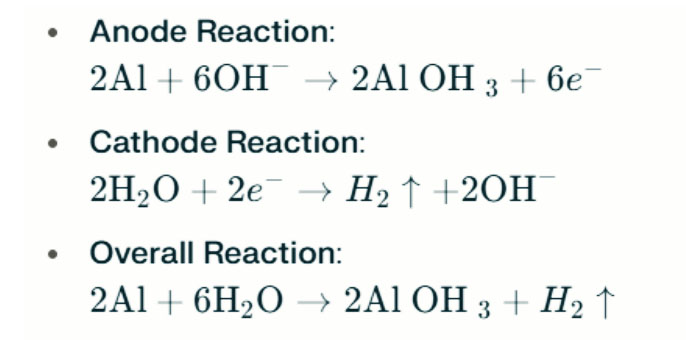
Te reakcije ponazarjajo proces evolucije vodika v močnih alkalnih okoljih, kar lahko privede do zmanjšanja zmogljivosti baterije.
V alkalnem okolju lahko koncentracija aluminijevih hidroksidnih ionov postane dovolj visoka, da lahko oborijo in tvorijo trdne delce. Sčasoma se lahko ti delci združijo v večje kristale. Vzroki za strjevanje vključujejo:
Povzetek
Tako lahko zamenjava slane vode z alkalnim elektrolitom povzroči podobna načela delovanja in reakcijske procese, vpliv alkalnega okolja na aktivnost aluminijeve kovine in korozije vodika lahko privede do razlik v končnih trdnih izdelkih in njihovih značilnostih. Te spremembe lahko izboljšajo učinkovitost reakcije, hkrati pa uvedejo tudi vprašanja o samokoroziji.
