WIDZIA: 0 Autor: Edytor witryny Publikuj Czas: 2025-01-02 Pochodzenie: Strona









Bateria aluminiowa Lampy słoneczne wytwarzają energię elektryczną poprzez reakcję elektrochemiczną między aluminium a tlenem w słonej wodzie (elektrolit). Gdy anoda aluminiowa styka się z katodą powietrzną, ulega utlenianiu, uwalniając elektrony i tworząc jony aluminiowe. Reakcje chemiczne są następujące:
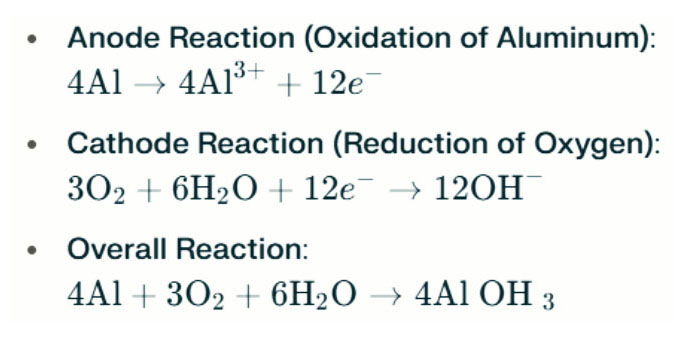
W tej reakcji glin (Al) reaguje z tlenem (O₂) i wodą (H₂O), aby wytwarzać wodorotlenek glinu (AL (OH) ₃), który wytrąca się jako kadłuba stała. Z czasem te stałe cząstki mogą agregować, tworząc większe struktury krystaliczne. W odpowiednich warunkach wodorotlenek glinu może dalej odwodnić, aby stać się tlenkiem glinu (Al₂o₃), co powoduje twardą stałą podobną do betonu. Ta cecha pozwala wynikającemu z siebie stałe do wytrzymania znacznego ciśnienia i sił zewnętrznych.
Jeśli słona woda zostanie zastąpiona elektrolitem alkalicznym (takim jak wodorotlenek sodu, NaOH lub wodorotlenek potasu, KOH), zasady działania i procesy reakcji będą się różnić. W środowiskach alkalicznych reakcja między glinem a tlenem pozostaje pierwotną reakcją elektrochemiczną. Jednak ze względu na środowisko alkaliczne zmniejszające warstwę pasywacyjną na aluminium jego aktywność elektrochemiczna jest zwiększona. Reakcje w elektrolicie alkalicznym można reprezentować w następujący sposób:

W tym przypadku glinu reaguje z jonami wodorotlenkowymi (OH⁻) i tlenem w celu wytwarzania jonów wodorotlenku glinu.
W silnych środowiskach alkalicznych glin może podlegać korozji ewolucji wodoru, uwalniając gaz wodoru. Reakcje chemiczne są następujące:
Wpływ stosowania elektrolitów alkalicznych
Jeśli słona woda zostanie zastąpiona elektrolitem alkalicznym (takim jak wodorotlenek sodu, NaOH lub wodorotlenek potasu, KOH), zasady działania i procesy reakcji będą się różnić. W środowiskach alkalicznych reakcja między glinem a tlenem pozostaje pierwotną reakcją elektrochemiczną. Jednak ze względu na środowisko alkaliczne zmniejszające warstwę pasywacyjną na aluminium jego aktywność elektrochemiczna jest zwiększona. Reakcje w elektrolicie alkalicznym można reprezentować w następujący sposób:
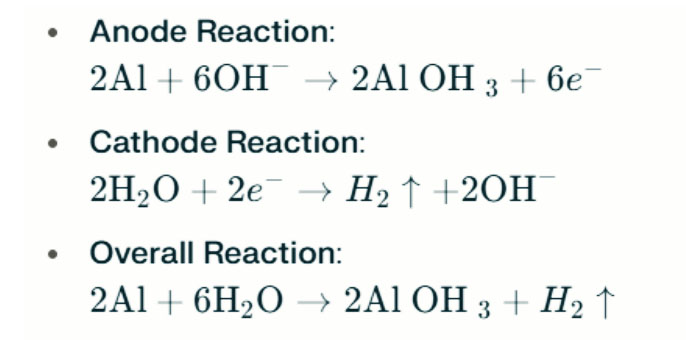
Reakcje te ilustrują proces ewolucji wodoru w silnych środowiskach alkalicznych, co może prowadzić do zmniejszonej wydajności baterii.
W środowiskach alkalicznych stężenie jonów wodorotlenku glinu może stać się wystarczająco wysokie, aby wytrącić i tworzyć stałe cząsteczki. Z czasem cząstki te mogą agregować w większe kryształy. Przyczyny zestalania obejmują:
Streszczenie
Zatem, zastępując słoną wodę elektrolitem alkalicznym, powoduje podobne zasady działania i procesy reakcji, wpływ środowiska alkalicznego na aktywność korozji ewolucji metali aluminiowych i ewolucji wodoru może prowadzić do różnic w końcowych produktach stałych i ich charakterystyce. Zmiany te mogą poprawić wydajność reakcji, ale także wprowadzać problemy z samokontrolem.
