Прагляды: 0 Аўтар: Рэдактар сайта Апублікаваць Час: 2025-01-02 Паходжанне: Пляцоўка









Акумулятар алюмініевага паветра Салёныя лямпы ствараюць электраэнергію праз электрахімічную рэакцыю паміж алюмініяй і кіслародам у салёнай вадзе (электраліт). Калі алюмініевы анод кантактуе з паветраным катодам, ён падвяргаецца акісленню, вылучаючы электроны і ўтвараючы алюмініевыя іёны. Хімічныя рэакцыі наступныя:
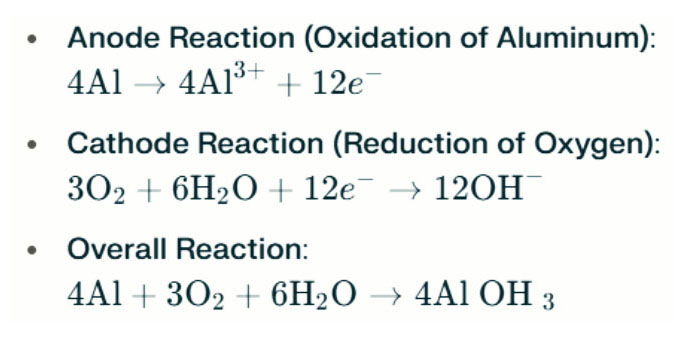
У гэтай рэакцыі алюміній (AL) рэагуе з кіслародам (O₂) і вадой (H₂o), каб вырабляць алюмініевы гідраксід (AL (OH) ₃), які асаджаецца як флокулентнае цвёрдае рэчыва. З цягам часу гэтыя цвёрдыя часціцы могуць утварацца, утвараючы вялікія крышталічныя структуры. У адпаведных умовах алюмініевы гідраксід можа яшчэ больш абязводзіць, каб стаць аксідам алюмінія (al₂o₃), што прыводзіць да цвёрдага цвёрдага рэчыва, падобнага на бетон. Гэтая характарыстыка дазваляе ўтульным цвёрдым вытрымкай значнага ціску і знешніх сіл.
Калі салёная вада замяняецца шчолачным электралітам (напрыклад, гідраксід натрыю, NaOH або калія, гідраксід, KOH), прынцыпы працы і працэсы рэакцыі будуць адрознівацца. У шчолачнай асяроддзі рэакцыя паміж алюмініем і кіслародам застаецца асноўнай электрахімічнай рэакцыяй. Аднак з -за шчолачнага асяроддзя, якая зніжае пасівацыйны пласт на алюмінія, яго электрахімічная актыўнасць узмацняецца. Рэакцыі шчолачнага электраліта могуць быць прадстаўлены наступным чынам:

У гэтым выпадку алюміній рэагуе з іёнамі гідраксіду (OH⁻) і кіслародам для атрымання алюмініевых іёнаў гідраксіду.
У моцных шчолачных умовах алюміній можа падвяргацца карозіі эвалюцыі вадароду, вылучаючы вадародны газ. Хімічныя рэакцыі наступныя:
Уплыў выкарыстання шчолачных электралітаў
Калі салёная вада замяняецца шчолачным электралітам (напрыклад, гідраксід натрыю, NaOH або калія, гідраксід, KOH), прынцыпы працы і працэсы рэакцыі будуць адрознівацца. У шчолачнай асяроддзі рэакцыя паміж алюмініем і кіслародам застаецца асноўнай электрахімічнай рэакцыяй. Аднак з -за шчолачнага асяроддзя, якая зніжае пасівацыйны пласт на алюмінія, яго электрахімічная актыўнасць узмацняецца. Рэакцыі шчолачнага электраліта могуць быць прадстаўлены наступным чынам:
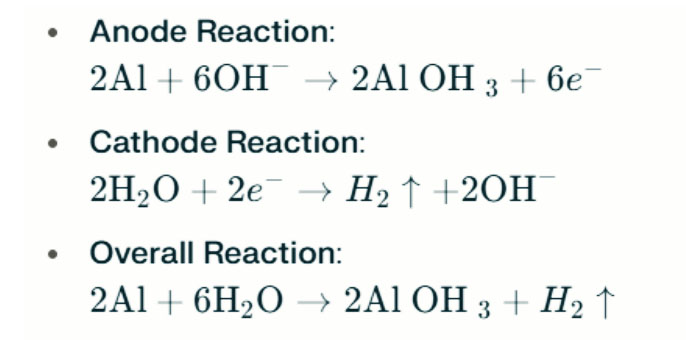
Гэтыя рэакцыі ілюструюць працэс эвалюцыі вадароду ў моцных шчолачных умовах, што можа прывесці да зніжэння прадукцыйнасці батарэі.
У шчолачных умовах канцэнтрацыя алюмініевых іёнаў гідраксіду можа стаць досыць высокай, каб яны ападкі і ўтварылі цвёрдыя часціцы. З цягам часу гэтыя часціцы могуць аб'яднацца ў вялікія крышталі. Прычыны застывання ўключаюць:
Сціслы пераказ
Такім чынам, пры замене салёнай вады шчолачным электралітам прыводзіць да аналагічных прынцыпаў працы і працэсаў рэакцыі, уплыў шчолачнага асяроддзя на актыўнасць алюмініевага металу і эвалюцыі эвалюцыі вадароду можа прывесці да адрозненняў у канчатковых цвёрдых прадуктах і іх характарыстыках. Гэтыя змены могуць павысіць эфектыўнасць рэакцыі, але таксама ўвядуць праблемы самакаразіі.
