Kyke: 0 Skrywer: Werfredakteur Publiseertyd: 2025-01-02 Oorsprong: Werf









Aluminium-lugbattery soutwaterlampe genereer elektrisiteit deur die elektrochemiese reaksie tussen aluminium en suurstof in soutwater (die elektroliet). Wanneer die aluminiumanode met die lugkatode in aanraking kom, ondergaan dit oksidasie, wat elektrone vrystel en aluminiumione vorm. Die betrokke chemiese reaksies is soos volg:
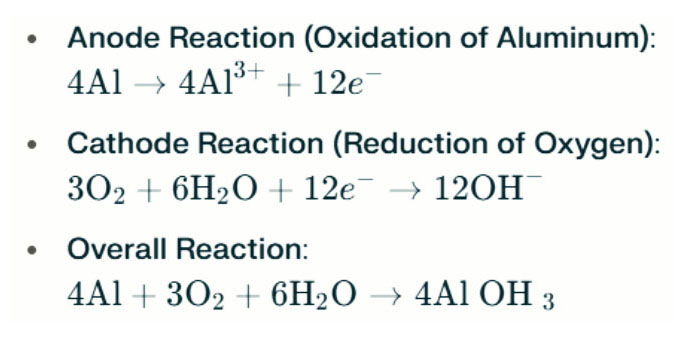
In hierdie reaksie reageer aluminium (Al) met suurstof (O₂) en water (H₂O) om aluminiumhidroksied (Al(OH)₃) te produseer, wat as 'n vlokkende vaste stof neerslaan. Met verloop van tyd kan hierdie vaste deeltjies saamvoeg om groter kristallyne strukture te vorm. Onder geskikte toestande kan aluminiumhidroksied verder dehidreer om aluminiumoksied (Al₂O₃) te word, wat 'n harde vastestof soortgelyk aan beton tot gevolg het. Hierdie eienskap laat die resulterende vaste stof beduidende druk en eksterne kragte weerstaan.
As soutwater met 'n alkaliese elektroliet (soos natriumhidroksied, NaOH, of kaliumhidroksied, KOH) vervang word, sal die werkingsbeginsels en reaksieprosesse verskil. In alkaliese omgewings bly die reaksie tussen aluminium en suurstof die primêre elektrochemiese reaksie. As gevolg van die alkaliese omgewing wat die passiveringslaag op aluminium verminder, word die elektrochemiese aktiwiteit daarvan egter verbeter. Die reaksies in 'n alkaliese elektroliet kan soos volg voorgestel word:

In hierdie geval reageer aluminium met hidroksiedione (OH⁻) en suurstof om aluminiumhidroksiedione te produseer.
In sterk alkaliese omgewings kan aluminium waterstof-evolusie-korrosie ondergaan, wat waterstofgas vrystel. Die chemiese reaksies is soos volg:
Impak van die gebruik van alkaliese elektroliete
As soutwater met 'n alkaliese elektroliet (soos natriumhidroksied, NaOH, of kaliumhidroksied, KOH) vervang word, sal die werkingsbeginsels en reaksieprosesse verskil. In alkaliese omgewings bly die reaksie tussen aluminium en suurstof die primêre elektrochemiese reaksie. As gevolg van die alkaliese omgewing wat die passiveringslaag op aluminium verminder, word die elektrochemiese aktiwiteit daarvan egter verbeter. Die reaksies in 'n alkaliese elektroliet kan soos volg voorgestel word:
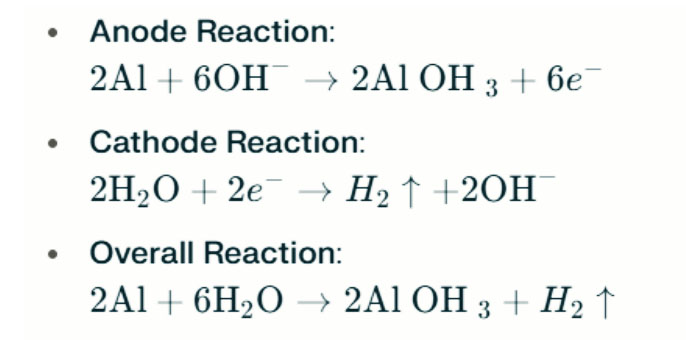
Hierdie reaksies illustreer die waterstof-evolusieproses in sterk alkaliese omgewings, wat kan lei tot verminderde batterywerkverrigting.
In alkaliese omgewings kan die konsentrasie van aluminiumhidroksiedione hoog genoeg word sodat hulle kan neerslaan en vaste deeltjies vorm. Met verloop van tyd kan hierdie deeltjies saamvoeg tot groter kristalle. Die oorsake van stolling sluit in:
Die gegenereerde aluminiumhidroksied presipiteer in die elektroliet en vorm geleidelik groter deeltjies.
Onder sekere omstandighede kan aluminiumhidroksied dehidreer en omskep in harder aluminiumoksied (Al₂O₃), wat 'n baie harde vaste stof tot gevolg het.
Die alkaliese omgewing kan lei tot digter strukture in die resulterende soliede materiaal, wat die hardheid daarvan verbeter.
Opsomming
Dus, terwyl die vervanging van soutwater met 'n alkaliese elektroliet soortgelyke bedryfsbeginsels en reaksieprosesse tot gevolg het, kan die invloed van die alkaliese omgewing op die aktiwiteit van aluminiummetaal en waterstofevolusie-korrosie tot verskille in die finale vaste produkte en hul eienskappe lei. Hierdie veranderinge kan reaksiedoeltreffendheid verbeter, maar kan ook probleme met selfkorrosie veroorsaak.
Wanneer soutwater bygevoeg word, reageer die aluminiumplaat met suurstof in die lug om aluminiumhidroksied te genereer. Hierdie verbinding versamel met verloop van tyd en vorm vaste deeltjies wat uiteindelik tot groter massas kan saamsmelt.
As daar 'n groot hoeveelheid soutwater is, sal alle aluminiumplate verbruik word; as daar minder soutwater is, sal hoofsaaklik die onderste plate verbruik word. Dit lei tot ongelyke dikte tussen die plate.
Soos chemiese reaksies voortduur, sal die ophoping van interne aluminiumhidroksied en vorming van vaste deeltjies druk op die aluminiumplate verhoog.
Dit word aanbeveel om daagliks die vloeibaarheid van gegenereerde aluminiumhidroksied na te gaan. As vloeibaarheid aansienlik verminder, vervang dit met vars soutwater; anders kan verharde deeltjies moeilik word om skoon te maak.
Indien dit nie binne drie uur gebruik word nie, maak onmiddellik leeg en spoel die uit soutwaterlamp se binnekant, droog dit dan in 'n geventileerde area terwyl dit op 'n koel, droë plek gebêre word.
Na veelvuldige gebruike kan oorblywende soutwater nie heeltemal uitgespoel word nie, wat lei tot passivering op die oppervlak van die aluminiumplate. Wanneer nuwe soutwater bygevoeg word, skakel eers die lamp aan om dit te ontlaai; dit sal die passiveringslaag op die plate ontwrig en normale werking herstel.
Soutwaterlampe het 'n lewensduur van minstens 120 uur en kan tot 20 jaar gestoor word sonder dat dit bykomende onderhoud tydens berging vereis. As 'n nuwe soort omgewingsvriendelike produk is dit geskik vir gebruik as noodbeligting, onderriggereedskap, of laai elektroniese toestelle in verskeie omgewings soos huise, hotelle, brandbestrydingsscenario's, visvanguitstappies, stapavonture, kampeeruitstappies, ens. Bestellings is welkom!
