Please Choose Your Language
نمایش ها: 0 نویسنده: ویرایشگر سایت زمان انتشار: 2025-01-02 مبدا: محل









باتری آلومینیوم-هوا لامپ های آب شور از طریق واکنش الکتروشیمیایی بین آلومینیوم و اکسیژن موجود در آب شور (الکترولیت) برق تولید می کنند. هنگامی که آند آلومینیوم با کاتد هوا تماس می گیرد ، تحت اکسیداسیون قرار می گیرد ، الکترون ها را آزاد می کند و یونهای آلومینیومی را تشکیل می دهد. واکنشهای شیمیایی درگیر به شرح زیر است:
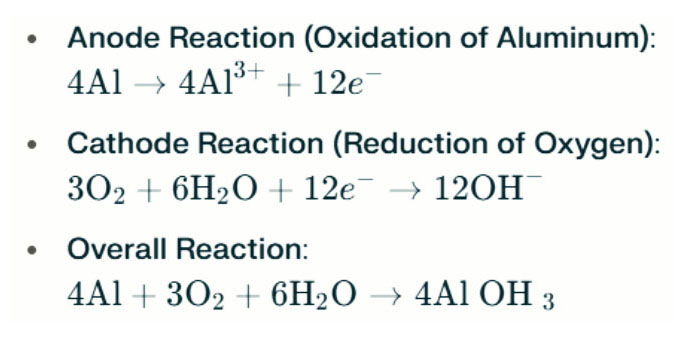
در این واکنش ، آلومینیوم (AL) با اکسیژن (O₂) و آب (H₂O) واکنش نشان می دهد تا هیدروکسید آلومینیوم (AL (OH) ₃) تولید کند ، که به عنوان یک جامد فلوکسی رسوب می کند. با گذشت زمان ، این ذرات جامد ممکن است جمع شوند تا ساختارهای کریستالی بزرگتر تشکیل شوند. در شرایط مناسب ، هیدروکسید آلومینیوم می تواند بیشتر کم آبی شود تا اکسید آلومینیوم (Al₂o₃) شود ، و در نتیجه یک جامد سخت شبیه به بتن ایجاد می شود. این ویژگی به جامد حاصل اجازه می دهد تا در برابر فشار قابل توجه و نیروهای خارجی مقاومت کند.
اگر آب نمکی با الکترولیت قلیایی (مانند هیدروکسید سدیم ، NaOH یا هیدروکسید پتاسیم ، KOH) جایگزین شود ، اصول عملیاتی و فرآیندهای واکنش متفاوت خواهد بود. در محیط های قلیایی ، واکنش بین آلومینیوم و اکسیژن واکنش الکتروشیمیایی اولیه است. با این حال ، با توجه به محیط قلیایی که باعث کاهش لایه انفعال روی آلومینیوم می شود ، فعالیت الکتروشیمیایی آن افزایش می یابد. واکنش های موجود در یک الکترولیت قلیایی را می توان به شرح زیر نشان داد:

در این حالت ، آلومینیوم با یونهای هیدروکسید (OH⁻) و اکسیژن واکنش نشان می دهد تا یونهای هیدروکسید آلومینیوم تولید شود.
در محیط های قلیایی قوی ، آلومینیوم می تواند تحت خوردگی تکامل هیدروژن قرار بگیرد و گاز هیدروژن را آزاد کند. واکنشهای شیمیایی به شرح زیر است:
تأثیر استفاده از الکترولیت های قلیایی
اگر آب نمکی با الکترولیت قلیایی (مانند هیدروکسید سدیم ، NaOH یا هیدروکسید پتاسیم ، KOH) جایگزین شود ، اصول عملیاتی و فرآیندهای واکنش متفاوت خواهد بود. در محیط های قلیایی ، واکنش بین آلومینیوم و اکسیژن واکنش الکتروشیمیایی اولیه است. با این حال ، با توجه به محیط قلیایی که باعث کاهش لایه انفعال روی آلومینیوم می شود ، فعالیت الکتروشیمیایی آن افزایش می یابد. واکنش های موجود در یک الکترولیت قلیایی را می توان به شرح زیر نشان داد:
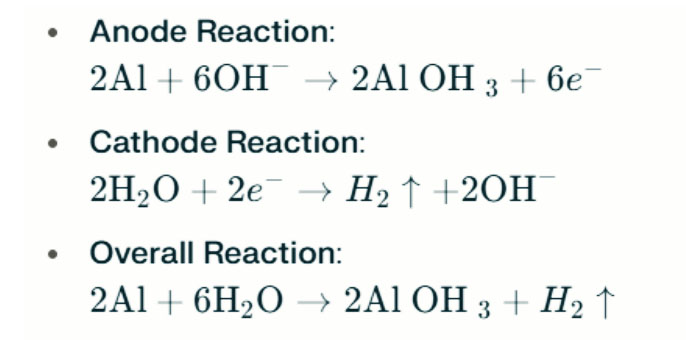
این واکنش ها روند تکامل هیدروژن را در محیط های قلیایی قوی نشان می دهد ، که می تواند منجر به کاهش عملکرد باتری شود.
در محیط های قلیایی ، غلظت یون های هیدروکسید آلومینیوم می تواند به اندازه کافی بالا باشد تا بتوانند ذرات جامد را رسوب و تشکیل دهند. با گذشت زمان ، این ذرات ممکن است در کریستال های بزرگتر جمع شوند. علل جامد سازی شامل موارد زیر است:
خلاصه
بنابراین ، در حالی که جایگزین کردن آب نمکی با یک الکترولیت قلیایی منجر به اصول عملیاتی مشابه و فرآیندهای واکنش می شود ، تأثیر محیط قلیایی بر فعالیت فلز آلومینیوم و خوردگی هیدروژن می تواند منجر به تفاوت در محصولات جامد نهایی و ویژگی های آنها شود. این تغییرات ممکن است راندمان واکنش را بهبود بخشد اما همچنین مشکلات خودآزمایی را معرفی می کند.
