Просмотры: 0 Автор: Редактор сайта Публикайте время: 2025-01-02 Происхождение: Сайт









Алюминиевая батарея Световодные лампы генерируют электричество посредством электрохимической реакции между алюминием и кислородом в соленой воде (электролит). Когда алюминиевый анод контактирует с воздушным катодом, он подвергается окислению, освобождая электроны и образуя ионы алюминия. Химические реакции следующие:
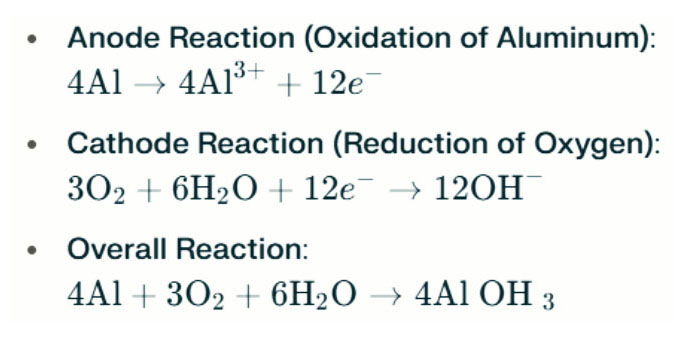
В этой реакции алюминий (Al) реагирует с кислородом (O₂) и водой (H₂O) с образованием гидроксида алюминия (Al (OH) ₃), который осаждается в виде флокулентного твердого вещества. Со временем эти твердые частицы могут агрегировать, образуя более крупные кристаллические структуры. В подходящих условиях гидроксид алюминия может дополнительно обезвоживание, чтобы стать оксидом алюминия (al₂o₃), что приводит к твердому твердому твердому твердому, сходному с бетоном. Эта характеристика позволяет получению твердого вещества выдерживать значительное давление и внешние силы.
Если соленая вода заменяется щелочным электролитом (например, гидроксид натрия, NaOH или гидроксида калия, KOH), принципы эксплуатации и процессы реакции будут отличаться. В щелочных средах реакция между алюминием и кислородом остается первичной электрохимической реакцией. Тем не менее, из -за щелочной среды, уменьшающей пассивирующий слой на алюминиевом, его электрохимическая активность усиливается. Реакции в щелочном электролите могут быть представлены следующим образом:

В этом случае алюминий реагирует с гидроксидными ионами (OH⁻) и кислородом с образованием ионов гидроксида алюминия.
В сильных щелочных средах алюминий может подвергаться коррозии эволюции водорода, высвобождая газ водорода. Химические реакции следующие:
Влияние использования щелочных электролитов
Если соленая вода заменяется щелочным электролитом (например, гидроксид натрия, NaOH или гидроксида калия, KOH), принципы эксплуатации и процессы реакции будут отличаться. В щелочных средах реакция между алюминием и кислородом остается первичной электрохимической реакцией. Тем не менее, из -за щелочной среды, уменьшающей пассивирующий слой на алюминиевом, его электрохимическая активность усиливается. Реакции в щелочном электролите могут быть представлены следующим образом:
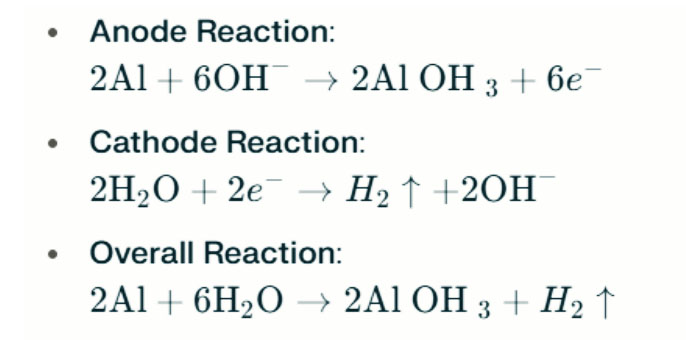
Эти реакции иллюстрируют процесс эволюции водорода в сильных щелочных средах, что может привести к снижению производительности батареи.
В щелочных средах концентрация ионов гидроксида алюминия может стать достаточно высокой, чтобы они могли осадить и образовывать твердые частицы. Со временем эти частицы могут объединиться в более крупные кристаллы. Причины затвердевания включают:
Краткое содержание
Таким образом, в то время как замена соленой воды щелочным электролитом приводит к аналогичным принципам эксплуатации и процессам реакции, влияние щелочной среды на активность коррозии алюминиевого металла и эволюции водорода может привести к различиям в конечных твердых продуктах и их характеристикам. Эти изменения могут повысить эффективность реакции, но также ввести проблемы с самообеспечкой.
