Visualizzazioni: 0 Autore: Editor del sito Publish Time: 2025-01-02 Origine: Sito









Batteria in alluminio-aria Le lampade in acqua salata generano elettricità attraverso la reazione elettrochimica tra alluminio e ossigeno nell'acqua salata (l'elettrolita). Quando l'anodo in alluminio contatta il catodo aereo, subisce ossidazione, rilasciando elettroni e formando ioni in alluminio. Le reazioni chimiche coinvolte sono le seguenti:
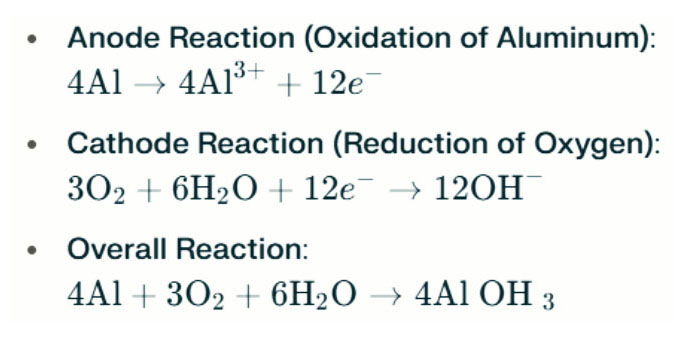
In questa reazione, l'alluminio (AL) reagisce con ossigeno (O₂) e acqua (H₂O) per produrre idrossido di alluminio (Al (OH) ₃), che precipita come solido flocculento. Nel tempo, queste particelle solide possono aggregarsi per formare strutture cristalline più grandi. In condizioni adeguate, l'idrossido di alluminio può ulteriormente disidratarsi per diventare ossido di alluminio (al₂o₃), con conseguente solido duro simile al calcestruzzo. Questa caratteristica consente al solido risultante di resistere alla pressione significativa e alle forze esterne.
Se l'acqua salata viene sostituita con un elettrolita alcalino (come idrossido di sodio, NaOH o idrossido di potassio, KOH), i principi operativi e i processi di reazione differiranno. In ambienti alcalini, la reazione tra alluminio e ossigeno rimane la reazione elettrochimica primaria. Tuttavia, a causa dell'ambiente alcalino che riduce lo strato di passivazione in alluminio, la sua attività elettrochimica è migliorata. Le reazioni in un elettrolita alcalino possono essere rappresentate come segue:

In questo caso, l'alluminio reagisce con ioni idrossido (OH⁻) e ossigeno per produrre ioni idrossido di alluminio.
In forti ambienti alcalini, l'alluminio può sottoporsi alla corrosione dell'evoluzione dell'idrogeno, rilasciando gas idrogeno. Le reazioni chimiche sono le seguenti:
Impatto dell'uso di elettroliti alcalini
Se l'acqua salata viene sostituita con un elettrolita alcalino (come idrossido di sodio, NaOH o idrossido di potassio, KOH), i principi operativi e i processi di reazione differiranno. In ambienti alcalini, la reazione tra alluminio e ossigeno rimane la reazione elettrochimica primaria. Tuttavia, a causa dell'ambiente alcalino che riduce lo strato di passivazione in alluminio, la sua attività elettrochimica è migliorata. Le reazioni in un elettrolita alcalino possono essere rappresentate come segue:
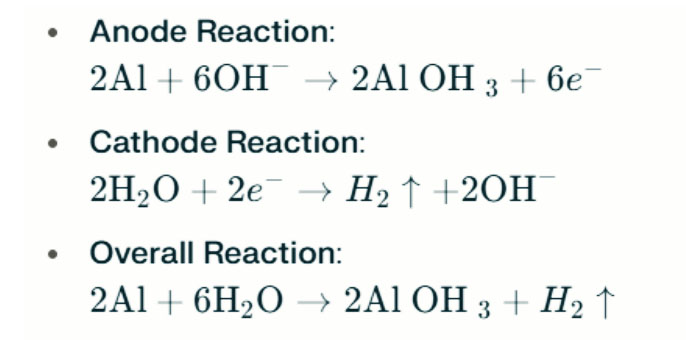
Queste reazioni illustrano il processo di evoluzione dell'idrogeno in forti ambienti alcalini, che possono portare a una riduzione delle prestazioni della batteria.
In ambienti alcalini, la concentrazione di ioni idrossido di alluminio può diventare abbastanza elevata per farli precipitare e formare particelle solide. Nel tempo, queste particelle possono aggregarsi in cristalli più grandi. Le cause di solidificazione includono:
Riepilogo
Pertanto, mentre la sostituzione dell'acqua salata con un elettrolita alcalino provoca simili principi operativi e processi di reazione, l'influenza dell'ambiente alcalino sull'attività della corrosione di metallo in alluminio e evoluzione dell'idrogeno può portare a differenze nei prodotti solidi finali e nelle loro caratteristiche. Questi cambiamenti possono migliorare l'efficienza di reazione ma anche introdurre problemi di autocorrosione.
