Tampilan: 0 Penulis: Editor Situs Penerbitan Waktu: 2025-01-02 Asal: Lokasi









Baterai Aluminium-Air Lampu air asin menghasilkan listrik melalui reaksi elektrokimia antara aluminium dan oksigen dalam air asin (elektrolit). Ketika anoda aluminium menghubungi katoda udara, ia mengalami oksidasi, melepaskan elektron dan membentuk ion aluminium. Reaksi kimia yang terlibat adalah sebagai berikut:
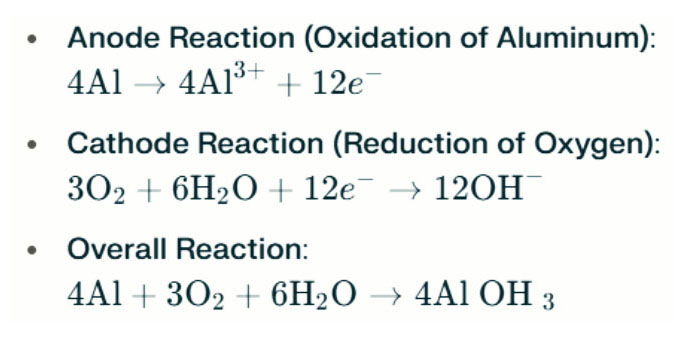
Dalam reaksi ini, aluminium (Al) bereaksi dengan oksigen (O₂) dan air (H₂O) untuk menghasilkan aluminium hidroksida (Al (OH) ₃), yang mengendap sebagai padatan flokulen. Seiring waktu, partikel -partikel padat ini dapat dikumpulkan untuk membentuk struktur kristal yang lebih besar. Dalam kondisi yang sesuai, aluminium hidroksida selanjutnya dapat mengalami dehidrasi menjadi aluminium oksida (al₂o₃), menghasilkan padatan keras yang mirip dengan beton. Karakteristik ini memungkinkan padatan yang dihasilkan untuk menahan tekanan yang signifikan dan kekuatan eksternal.
Jika air asin diganti dengan elektrolit alkali (seperti natrium hidroksida, NaOH, atau kalium hidroksida, KOH), prinsip operasi dan proses reaksi akan berbeda. Dalam lingkungan alkali, reaksi antara aluminium dan oksigen tetap menjadi reaksi elektrokimia primer. Namun, karena lingkungan basa mengurangi lapisan pasif pada aluminium, aktivitas elektrokimia ditingkatkan. Reaksi dalam elektrolit basa dapat direpresentasikan sebagai berikut:

Dalam hal ini, aluminium bereaksi dengan ion hidroksida (OH⁻) dan oksigen untuk menghasilkan ion aluminium hidroksida.
Dalam lingkungan alkali yang kuat, aluminium dapat mengalami korosi evolusi hidrogen, melepaskan gas hidrogen. Reaksi kimianya adalah sebagai berikut:
Dampak menggunakan elektrolit alkali
Jika air asin diganti dengan elektrolit alkali (seperti natrium hidroksida, NaOH, atau kalium hidroksida, KOH), prinsip operasi dan proses reaksi akan berbeda. Dalam lingkungan alkali, reaksi antara aluminium dan oksigen tetap menjadi reaksi elektrokimia primer. Namun, karena lingkungan basa mengurangi lapisan pasif pada aluminium, aktivitas elektrokimia ditingkatkan. Reaksi dalam elektrolit basa dapat direpresentasikan sebagai berikut:
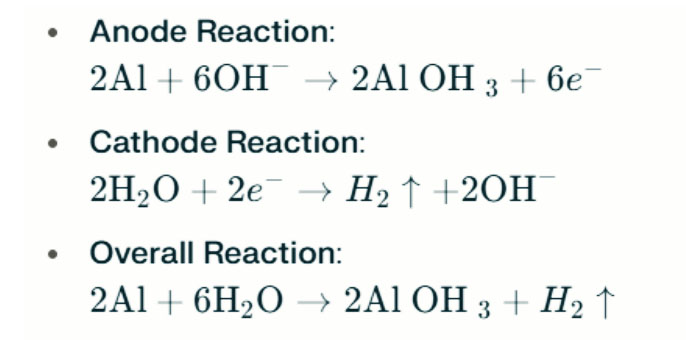
Reaksi ini menggambarkan proses evolusi hidrogen di lingkungan alkali yang kuat, yang dapat menyebabkan penurunan kinerja baterai.
Dalam lingkungan alkali, konsentrasi ion aluminium hidroksida dapat menjadi cukup tinggi bagi mereka untuk mengendapkan dan membentuk partikel padat. Seiring waktu, partikel -partikel ini dapat dikumpulkan menjadi kristal yang lebih besar. Penyebab pemadatan meliputi:
Ringkasan
Dengan demikian, sementara mengganti air asin dengan elektrolit alkali menghasilkan prinsip operasi yang sama dan proses reaksi, pengaruh lingkungan alkali pada aktivitas logam aluminium dan korosi evolusi hidrogen dapat menyebabkan perbedaan dalam produk padat akhir dan karakteristiknya. Perubahan ini dapat meningkatkan efisiensi reaksi tetapi juga memperkenalkan masalah korosi diri.
