Zobrazení: 0 Autor: Editor webů Publikování Čas: 2025-01-02 Původ: Místo









Baterie hliníku Lampy slané vody vytvářejí elektřinu elektrochemickou reakcí mezi hliníkem a kyslíkem v slané vodě (elektrolyt). Když hliníková anoda kontaktuje vzduchovou katodu, podstoupí oxidaci, uvolňuje elektrony a vytváří hliníkové ionty. Zúčastněné chemické reakce jsou následující:
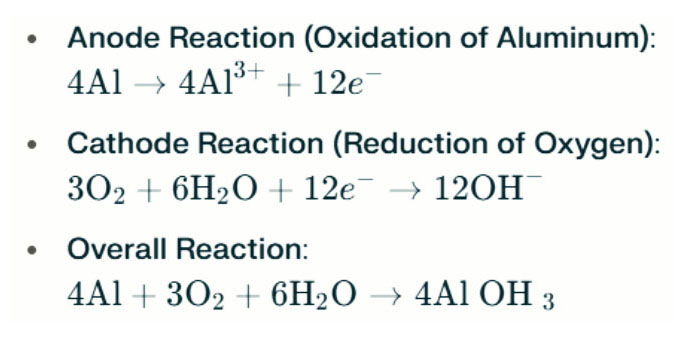
V této reakci reaguje hliník (AL) s kyslíkem (O₂) a vodou (H₂O) za vzniku hydroxidu hlinitého (AL (OH) ₃), který vyvolává jako flokulentní pelič. V průběhu času se tyto pevné částice mohou agregovat za vzniku větších krystalických struktur. Za vhodných podmínek může hydroxid hlinitý dále dehydratovat, aby se stal oxidem hlinitého (al₂o₃), což vede k tvrdé pevné látce podobné betonu. Tato charakteristika umožňuje výsledné pevné látce vydržet významný tlak a vnější síly.
Pokud je slaná voda nahrazena alkalickým elektrolytem (jako je hydroxid sodný, naoh nebo hydroxid draselný, KOH), budou se lišit provozní principy a reakční procesy. V alkalickém prostředí zůstává reakce mezi hliníkem a kyslíkem primární elektrochemickou reakcí. Avšak vzhledem k alkalickému prostředí snižování pasivační vrstvy na hliníku je však jeho elektrochemická aktivita zvýšena. Reakce v alkalickém elektrolytu lze reprezentovat následovně:

V tomto případě hliník reaguje s hydroxidovým ionty (OH⁻) a kyslíkem za vzniku iontů hydroxidu hlinitého.
V silném alkalickém prostředí může hliník podstoupit korozi vývoje vodíku a uvolnit vodíkový plyn. Chemické reakce jsou následující:
Dopad použití alkalických elektrolytů
Pokud je slaná voda nahrazena alkalickým elektrolytem (jako je hydroxid sodný, naoh nebo hydroxid draselný, KOH), budou se lišit provozní principy a reakční procesy. V alkalickém prostředí zůstává reakce mezi hliníkem a kyslíkem primární elektrochemickou reakcí. Avšak vzhledem k alkalickému prostředí snižování pasivační vrstvy na hliníku je však jeho elektrochemická aktivita zvýšena. Reakce v alkalickém elektrolytu lze reprezentovat následovně:
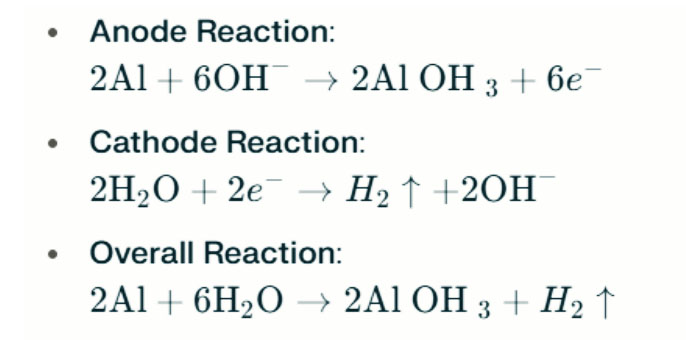
Tyto reakce ilustrují proces vývoje vodíku ve silných alkalických prostředích, což může vést ke snížení výkonu baterie.
V alkalickém prostředí může koncentrace iontů hydroxidu hlinitého být dostatečně vysoká, aby mohly srážet a tvořit pevné částice. Postupem času se tyto částice mohou agregovat do větších krystalů. Mezi příčiny tuhnutí patří:
Shrnutí
Zatímco nahrazení slané vody alkalickým elektrolytem má za následek podobné operační principy a reakční procesy, vliv alkalického prostředí na aktivitu koroze hliníku a koroze vodíku může vést k rozdílům v konečných pevných produktech a jejich charakteristikách. Tyto změny mohou zlepšit účinnost reakce, ale také zavádět problémy s vlastním úpravou.
