Visualizações: 0 Autor: Editor de sites Publicar Tempo: 2025-01-02 Origem: Site









Bateria de alumínio-ar As lâmpadas de água salgada geram eletricidade através da reação eletroquímica entre alumínio e oxigênio na água salgada (o eletrólito). Quando o ânodo de alumínio entra em contato com o cátodo de ar, ele passa por oxidação, liberando elétrons e formando íons de alumínio. As reações químicas envolvidas são as seguintes:
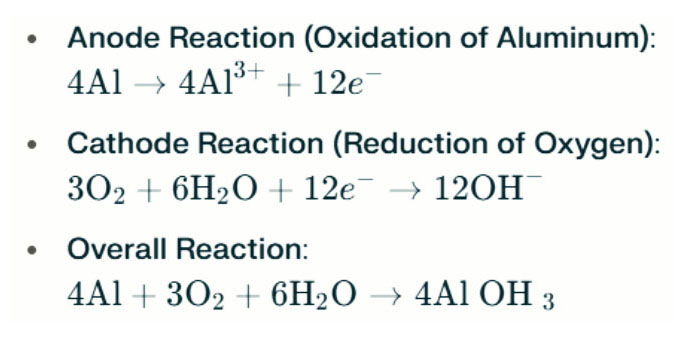
Nesta reação, o alumínio (Al) reage com oxigênio (O₂) e água (H₂O) para produzir hidróxido de alumínio (Al (OH) ₃), que precipita como um sólido floculento. Com o tempo, essas partículas sólidas podem se agregar para formar estruturas cristalinas maiores. Sob condições adequadas, o hidróxido de alumínio pode desidratar ainda mais o óxido de alumínio (Al₂o₃), resultando em um sólido duro semelhante ao concreto. Essa característica permite que o sólido resultante suporta pressão significativa e forças externas.
Se a água salgada for substituída por um eletrólito alcalino (como hidróxido de sódio, NaOH ou hidróxido de potássio, KOH), os princípios operacionais e processos de reação serão diferentes. Nos ambientes alcalinos, a reação entre alumínio e oxigênio continua sendo a reação eletroquímica primária. No entanto, devido ao ambiente alcalino, reduzindo a camada de passivação no alumínio, sua atividade eletroquímica é aprimorada. As reações em um eletrólito alcalino podem ser representadas da seguinte forma:

Nesse caso, o alumínio reage com íons hidróxido (OH⁻) e oxigênio para produzir íons hidróxido de alumínio.
Em ambientes alcalinos fortes, o alumínio pode sofrer corrosão da evolução do hidrogênio, liberando gás hidrogênio. As reações químicas são as seguintes:
Impacto do uso de eletrólitos alcalinos
Se a água salgada for substituída por um eletrólito alcalino (como hidróxido de sódio, NaOH ou hidróxido de potássio, KOH), os princípios operacionais e processos de reação serão diferentes. Nos ambientes alcalinos, a reação entre alumínio e oxigênio continua sendo a reação eletroquímica primária. No entanto, devido ao ambiente alcalino, reduzindo a camada de passivação no alumínio, sua atividade eletroquímica é aprimorada. As reações em um eletrólito alcalino podem ser representadas da seguinte forma:
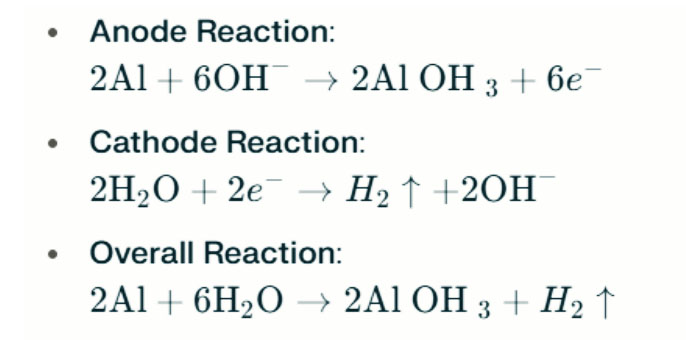
Essas reações ilustram o processo de evolução do hidrogênio em fortes ambientes alcalinos, o que pode levar à diminuição do desempenho da bateria.
Nos ambientes alcalinos, a concentração de íons hidróxido de alumínio pode se tornar alta o suficiente para que eles precipitem e forme partículas sólidas. Com o tempo, essas partículas podem se agregar em cristais maiores. As causas de solidificação incluem:
Resumo
Assim, enquanto a substituição da água salgada por um eletrólito alcalino resulta em princípios operacionais e processos de reação semelhantes, a influência do ambiente alcalino na atividade de corrosão de metal e evolução de hidrogênio pode levar a diferenças nos produtos sólidos finais e suas características. Essas mudanças podem melhorar a eficiência da reação, mas também introduzir problemas de autocorrosão.
