Vistas: 0 Autor: Sitio Editor Publicar Tiempo: 2025-01-02 Origen: Sitio









Batería de aluminio Las lámparas de agua salada generan electricidad a través de la reacción electroquímica entre el aluminio y el oxígeno en agua salada (el electrolito). Cuando el ánodo de aluminio contacta con el cátodo de aire, sufre oxidación, libera electrones y formando iones de aluminio. Las reacciones químicas involucradas son las siguientes:
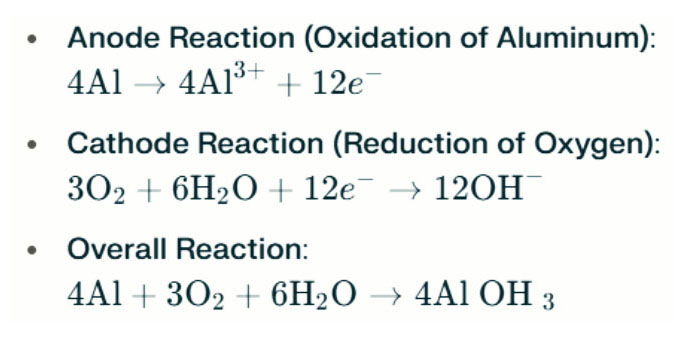
En esta reacción, el aluminio (Al) reacciona con oxígeno (O₂) y agua (H₂O) para producir hidróxido de aluminio (Al (OH) ₃), que precipita como un sólido floculento. Con el tiempo, estas partículas sólidas pueden agregarse para formar estructuras cristalinas más grandes. En condiciones adecuadas, el hidróxido de aluminio puede deshidratarse aún más para convertirse en óxido de aluminio (Al₂o₃), lo que resulta en un sólido duro similar al concreto. Esta característica permite que el sólido resultante resistirá una presión significativa y fuerzas externas.
Si el agua salada se reemplaza con un electrolito alcalino (como hidróxido de sodio, NaOH o hidróxido de potasio, KOH), los principios operativos y los procesos de reacción diferirán. En ambientes alcalinos, la reacción entre el aluminio y el oxígeno sigue siendo la reacción electroquímica primaria. Sin embargo, debido al entorno alcalino que reduce la capa de pasivación en aluminio, se mejora su actividad electroquímica. Las reacciones en un electrolito alcalino se pueden representar de la siguiente manera:

En este caso, el aluminio reacciona con iones de hidróxido (OH⁻) y oxígeno para producir iones de hidróxido de aluminio.
En ambientes alcalinos fuertes, el aluminio puede sufrir corrosión por evolución de hidrógeno, liberando gas de hidrógeno. Las reacciones químicas son las siguientes:
Impacto del uso de electrolitos alcalinos
Si el agua salada se reemplaza con un electrolito alcalino (como hidróxido de sodio, NaOH o hidróxido de potasio, KOH), los principios operativos y los procesos de reacción diferirán. En ambientes alcalinos, la reacción entre el aluminio y el oxígeno sigue siendo la reacción electroquímica primaria. Sin embargo, debido al entorno alcalino que reduce la capa de pasivación en aluminio, se mejora su actividad electroquímica. Las reacciones en un electrolito alcalino se pueden representar de la siguiente manera:
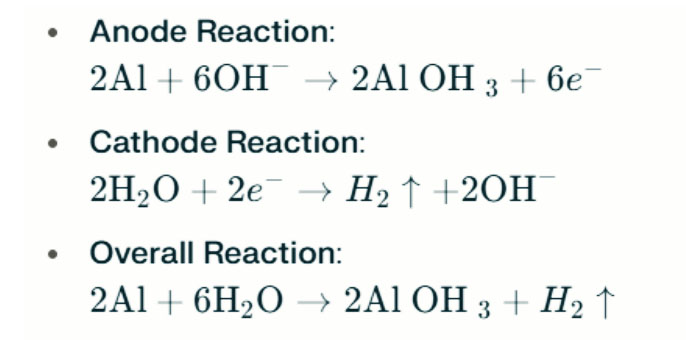
Estas reacciones ilustran el proceso de evolución de hidrógeno en entornos alcalinos fuertes, lo que puede conducir a una disminución del rendimiento de la batería.
En ambientes alcalinos, la concentración de iones de hidróxido de aluminio puede volverse lo suficientemente alto como para que precipitaran y formen partículas sólidas. Con el tiempo, estas partículas pueden agregarse en cristales más grandes. Las causas de solidificación incluyen:
Resumen
Por lo tanto, al reemplazar el agua salada con un electrolito alcalino da como resultado principios operativos similares y procesos de reacción, la influencia del entorno alcalino en la actividad del metal de aluminio y la corrosión por evolución de hidrógeno puede conducir a diferencias en los productos sólidos finales y sus características. Estos cambios pueden mejorar la eficiencia de la reacción pero también introducir problemas de autocorrosión.
